L’hyperlymphocytose duodénale ne conduit pas systématiquement à une maladie cœliaque, bien que l’association entre infiltration lymphocytaire et pathologies auto-immunes duodénales soit fréquemment évoquée. Plus de 10 % des biopsies duodénales montrent des anomalies immunitaires sans correspondance clinique immédiate.
Les critères morphologiques, la répartition des lymphocytes intra-épithéliaux et les marqueurs sérologiques bouleversent la frontière entre entéropathies auto-immunes et hypersensibilités alimentaires. Les stratégies diagnostiques et thérapeutiques dépendent d’une compréhension fine des mécanismes immunologiques en jeu, ainsi que de la capacité à distinguer les différentes entités nosologiques impliquées.
Duodénite et maladies auto-immunes duodénales : comprendre le contexte et les enjeux
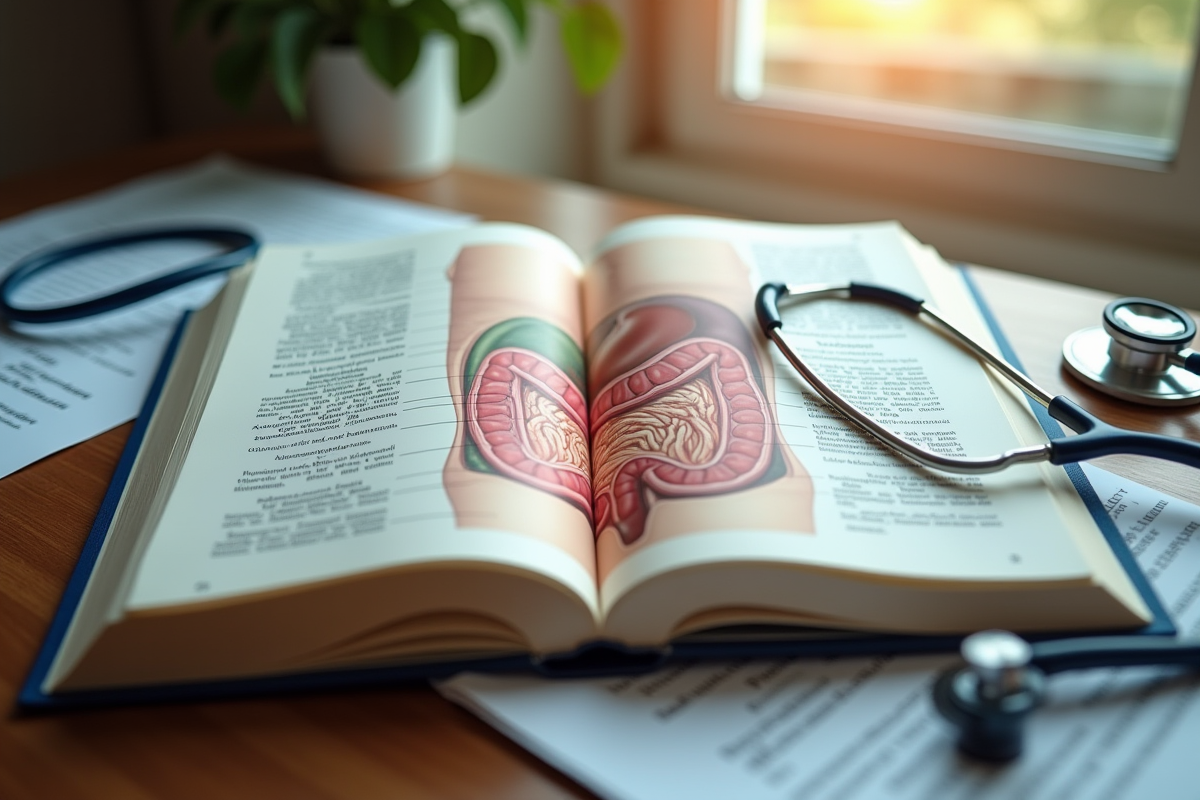
Derrière son nom technique, la duodénite reste largement méconnue et souvent reléguée au second plan, alors qu’elle révèle la complexité des maladies auto-immunes duodénales et la rareté de certaines entéropathies. L’inflammation du duodénum se traduit par une véritable invasion lymphocytaire, signe d’un déséquilibre profond de l’immunité au niveau de la muqueuse digestive. Ce phénomène s’observe aussi bien dans le cadre d’un déficit immunitaire variable que lors d’une entéropathie auto-immune, deux situations marquées par un dialogue perturbé entre la muqueuse intestinale et les antigènes d’origine alimentaire.
Le champ des maladies auto-immunes duodénales ne se limite pas à la maladie cœliaque. Les médecins sont régulièrement confrontés à des formes associées à la maladie de Crohn ou encore à des déficits immunitaires primitifs, avec des manifestations très variées : malabsorption, diarrhée chronique, stéatorrhée, autant de tableaux cliniques qui imposent un examen histologique minutieux. La diversité des diagnostics possibles rend chaque cas unique, et l’analyse des prélèvements reste le juge de paix.
Facteurs de risque et présentation clinique
Voici les principaux éléments à surveiller chez les patients exposés à une duodénite auto-immune :
- Présence d’autres maladies auto-immunes ou antécédents familiaux
- Contextes d’entéropathies auto-immunes documentés
- Signes digestifs atypiques chez un patient porteur d’un déficit immunitaire variable
La démarche thérapeutique repose sur une évaluation clinique précise, complétée par des examens adaptés. L’étude des biopsies duodénales, associée à l’immunohistochimie, affine la recherche diagnostique. Les progrès récents en gastro-entérologie ont ouvert la voie à une prise en charge sur mesure, adaptée à la singularité des mécanismes immunitaires et au profil de chaque patient.
Quels sont les symptômes et signes d’alerte à surveiller ?
Chez l’adulte, la duodénite auto-immune avance souvent masquée, avec des symptômes parfois diffus et difficiles à relier d’emblée. Des douleurs abdominales, situées le plus souvent dans la partie haute, constituent le signal le plus fréquent mais ne permettent pas à elles seules d’identifier la maladie. Diarrhée chronique, fatigue persistante, amaigrissement inexpliqué ou malabsorption s’invitent régulièrement dans le tableau.
Lorsque la muqueuse duodénale est agressée par le système immunitaire, une atrophie villositaire peut apparaître, à la manière de ce qu’on observe dans la maladie cœliaque, sans que la présentation clinique ne soit identique. Il arrive que s’ajoutent nausées, vomissements, perte d’appétit ou inconfort après les repas, autant de signes qui témoignent d’une atteinte du haut appareil digestif. L’endoscopie, souvent incontournable, révèle des traces d’inflammation, parfois des érosions ou des ulcérations.
Dans certaines situations, d’autres symptômes plus ciblés se manifestent : la coexistence d’une gastrite chronique ou d’une gastrite atrophique traduit une inflammation qui déborde la seule muqueuse duodénale. À l’examen, une infiltration de lymphocytes intraépithéliaux met en lumière l’activité du système immunitaire.
On retrouve régulièrement les signes suivants chez les personnes concernées :
- Perte de poids inexpliquée
- Douleurs épigastriques récidivantes
- Diarrhée chronique ou alternance avec constipation
- Signes de carence (anémie, hypoprotéinémie)
Une attention particulière s’impose pour les patients ayant déjà une maladie auto-immune ou présentant un déficit immunitaire variable. L’association de plusieurs de ces signes doit conduire à orienter le patient vers une expertise spécialisée, pour prévenir la survenue d’une atrophie villositaire intestinale qui pourrait s’installer durablement.
Biopsies duodénales et diagnostic de l’hyperlymphocytose : ce qu’il faut savoir
Pour les spécialistes, aucun doute : la biopsie duodénale reste la clef de voûte du diagnostic quand une duodénite d’origine auto-immune est suspectée. L’analyse exige méthode et expertise. Lors de la fibroscopie, il convient de prélever plusieurs fragments de la muqueuse duodénale, idéalement quatre, répartis entre le bulbe et la seconde portion du duodénum. Ce protocole permet de repérer une éventuelle hyperlymphocytose intraépithéliale ou la présence d’une atrophie villositaire.
Une infiltration de lymphocytes intraépithéliaux dépassant 25 pour 100 entérocytes oriente souvent le diagnostic, un seuil également utilisé dans la maladie cœliaque. L’immunohistochimie apporte des précisions : un infiltrat lymphocytaire T CD3+, CD8+ suggère une pathologie auto-immune, tandis qu’une atrophie isolée, sans hyperlymphocytose, évoquera plus volontiers un déficit immunitaire variable commun ou une autre entéropathie auto-immune.
À la croisée des diagnostics :
Voici quelques exemples concrets pour guider l’interprétation des résultats :
- Maladie cœliaque : atrophie villositaire, hyperlymphocytose, et anticorps anti-transglutaminase détectés.
- Déficit immunitaire variable : lésions atrophiques avec chute des immunoglobulines sériques.
- Entéropathies auto-immunes : infiltration lymphocytaire sans anticorps cœliaques spécifiques.
Seule la confrontation des données cliniques, biologiques et morphologiques permet d’avancer. Les sociétés savantes comme l’ACG et l’ESPGHAN rappellent l’importance d’une évaluation multi-disciplinaire, associant pathologistes, praticiens et biologistes. La détection d’anticorps spécifiques, le dosage des immunoglobulines et, dans certains cas, une IRM entérale, affinent encore le diagnostic et évitent les erreurs d’orientation.
Traitements actuels et différences essentielles avec la maladie cœliaque
La prise en charge de la duodénite d’origine auto-immune s’écarte nettement de celle de la maladie cœliaque. Ici, pas de régime sans gluten obligatoire : le mécanisme inflammatoire qui attaque la muqueuse duodénale n’a rien à voir avec la présence de gluten.
Lorsqu’il s’agit d’une entéropathie auto-immune, la corticothérapie s’impose souvent comme le premier recours. Les corticoïdes administrés par voie orale, parfois associés à des immunosuppresseurs comme l’azathioprine, servent à réduire l’inflammation et à réparer la muqueuse. Si des symptômes gastriques persistent, on ajoute des inhibiteurs de la pompe à protons ; ils ne modifient toutefois pas la réaction immunitaire de fond.
Pour mieux comprendre cette différence, voici un tableau synthétique :
| Duodénite auto-immune | Maladie cœliaque |
|---|---|
| Corticothérapie ± immunosuppresseurs ± inhibiteurs pompe à protons |
Régime strict sans gluten à vie |
L’éradication de Helicobacter pylori n’est envisagée qu’en cas d’infection avérée, et n’influence pas le processus auto-immun en lui-même. Un suivi clinique et biologique régulier s’impose, pour ajuster les traitements, surveiller l’apparition de complications et prévenir une atrophie persistante de la muqueuse duodénale.
La distinction avec la maladie cœliaque repose donc sur l’origine de la réponse immunitaire, la nature des traitements utilisés et la façon dont le suivi est organisé sur le long terme. Une prise en charge individualisée, adaptée au profil immunitaire et aux antécédents du patient, conduit à une évolution plus favorable et à une meilleure qualité de vie.
Au fil des années, l’observation et la précision du diagnostic dessinent une nouvelle cartographie de ces entéropathies rares. Entre certitudes scientifiques et zones d’ombre, la duodénite auto-immune rappelle que le corps humain ne livre jamais ses secrets sans résistance.